
2024年1月10日,中國醫(yī)學科學院血液病醫(yī)院(中國醫(yī)學科學院血液學研究所)郝牧/邱錄貴團隊在eBioMedicine《電子生物醫(yī)學》雜志發(fā)表了題為“CRIP1 involves the pathogenesis of multiple myeloma via dual-regulation of proteasome and autophagy”的研究論文(CRIP1通過增強蛋白酶體和自噬活性介導多發(fā)性骨髓瘤對蛋白酶體抑制劑耐藥)。該研究在國際上首次闡明了支架蛋白CRIP1參與自噬、蛋白酶體活性等蛋白質穩(wěn)態(tài)調控的分子機制,及其在多發(fā)性骨髓瘤的增殖、耐藥、疾病復發(fā)中的作用及分子機制。
多發(fā)性骨髓瘤(MM)是一種漿細胞惡性腫瘤,蛋白質穩(wěn)態(tài)調控在多發(fā)性骨髓瘤發(fā)病機制中發(fā)揮重要作用。蛋白酶體抑制劑靶向抑制泛素-蛋白酶體系統(tǒng)(UPS)而導致細胞內蛋白質累積,破壞蛋白質穩(wěn)態(tài)從而誘導MM細胞凋亡,發(fā)揮抗骨髓瘤作用。然而,MM細胞可通過自噬等蛋白質降解機制,重新恢復自身蛋白質穩(wěn)態(tài),進而介導細胞對蛋白酶抑制劑(PIs)藥物產生耐藥性。因此,闡明MM細胞蛋白質穩(wěn)態(tài)調控的分子機制和關鍵信號通路將為克服MM細胞耐藥,發(fā)現(xiàn)潛在治療靶點提供理論依據(jù)。
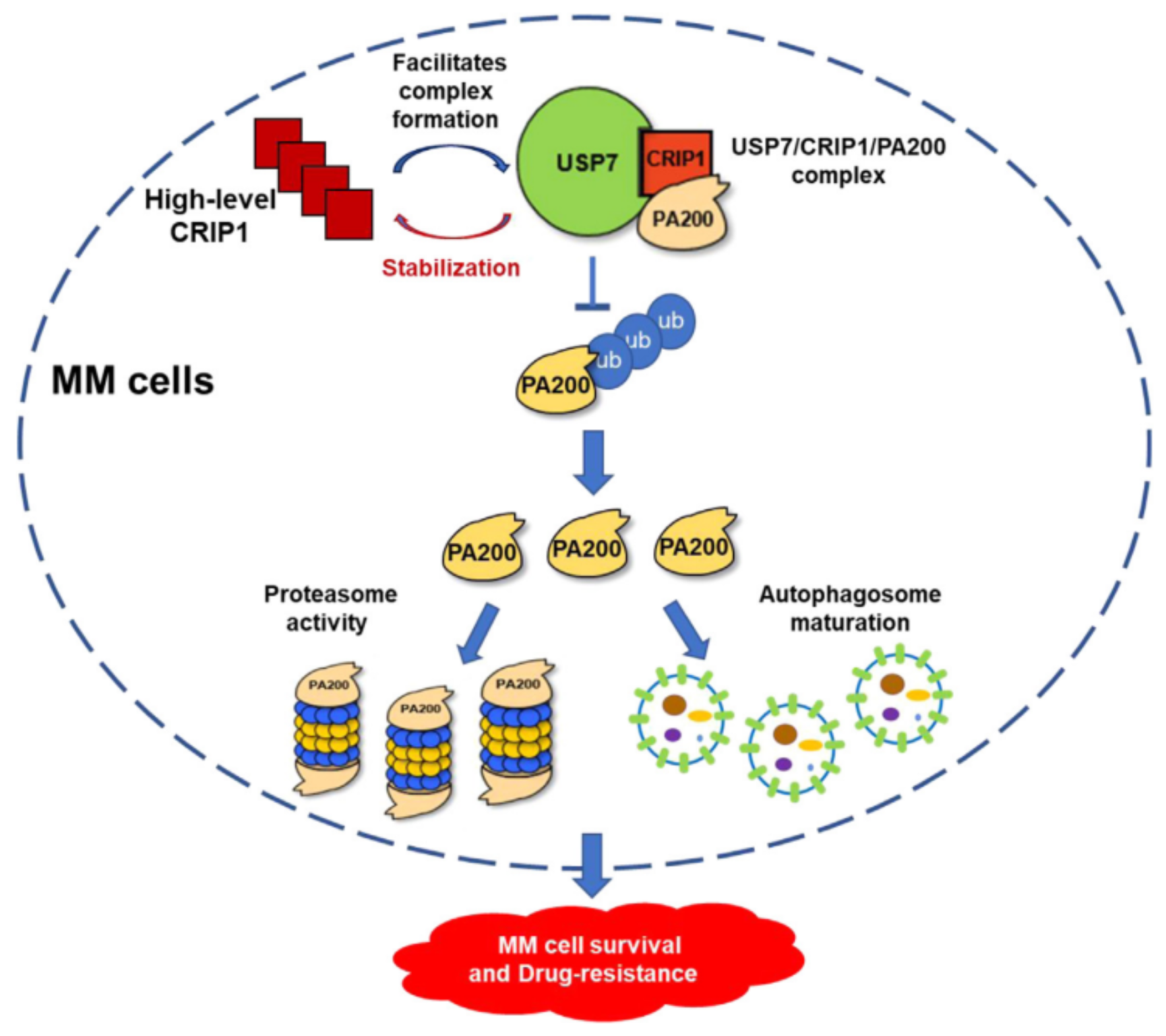
該研究發(fā)現(xiàn)CRIP1在MM細胞,尤其是復發(fā)/難治性MM細胞中表達升高,且MM細胞中CRIP1高表達與患者不良預后顯著相關。CRIP1基因敲除顯著抑制了MM細胞的生長、侵襲和遷移,增加MM細胞對PIs誘導的細胞生長阻滯的敏感性,同時基因敲除的MM細胞蛋白酶體活性和自噬活性均顯著降低。通過蛋白質譜和Co-IP分析,發(fā)現(xiàn)CRIP1可與去泛素化酶USP7及蛋白酶體亞基PA200形成復合物,一方面穩(wěn)定CRIP1在MM細胞內高水平表達,另一方面有利于USP7與PA200的相互作用,促進USP7介導的PA200去泛素化并增強其穩(wěn)定性,從而促進MM細胞的存活和耐藥。此外,在CRIP1過表達的MM細胞系中分別敲低USP7或PA200基因,會顯著抑制MM細胞蛋白酶體活性以及自噬活性,從而增強MM細胞對PIs的敏感性。綜上,該研究首次揭示支架蛋白CRIP1通過多途徑調控多發(fā)性骨髓瘤細胞蛋白質穩(wěn)態(tài),促進腫瘤細胞耐藥性的產生和疾病進展,為發(fā)現(xiàn)潛在治療靶點提供理論依據(jù)。
該研究獲得中國醫(yī)學科學院醫(yī)學與健康科技創(chuàng)新工程(2021-I2M-1-040)、國家自然科學基金(面上項目82370210、國際(地區(qū))合作與交流項目81920108006)等的支持。血液病醫(yī)院郝牧研究員、邱錄貴主任醫(yī)師和福建醫(yī)科大學附屬協(xié)和醫(yī)院許貞書主任醫(yī)師為共同通訊作者,血液病醫(yī)院博士研究生唐培霞、于珍副主任技師為共同第一作者。
論文鏈接:https://authors.elsevier.com/sd/article/S2352396423005273