
2023年5月10日,中國醫學科學院藥物研究所賀玖明與齊魯工業大學(山東省科學院)孫成龍、北京大學腫瘤醫院季加孚/步召德、上海市生物醫藥技術研究院戴文韜等合作,在Nature Communications(《自然?通訊》)雜志上在線發表了題為“Spatially resolved multi-omics highlights cell-specific metabolic remodeling and interactions in gastric cancer”(空間分辨多組學揭示胃癌相關細胞特異的代謝重編程與相互作用)的研究論文,在空間分辨多組學新技術研發及腫瘤代謝交互作用研究方面取得重要進展。
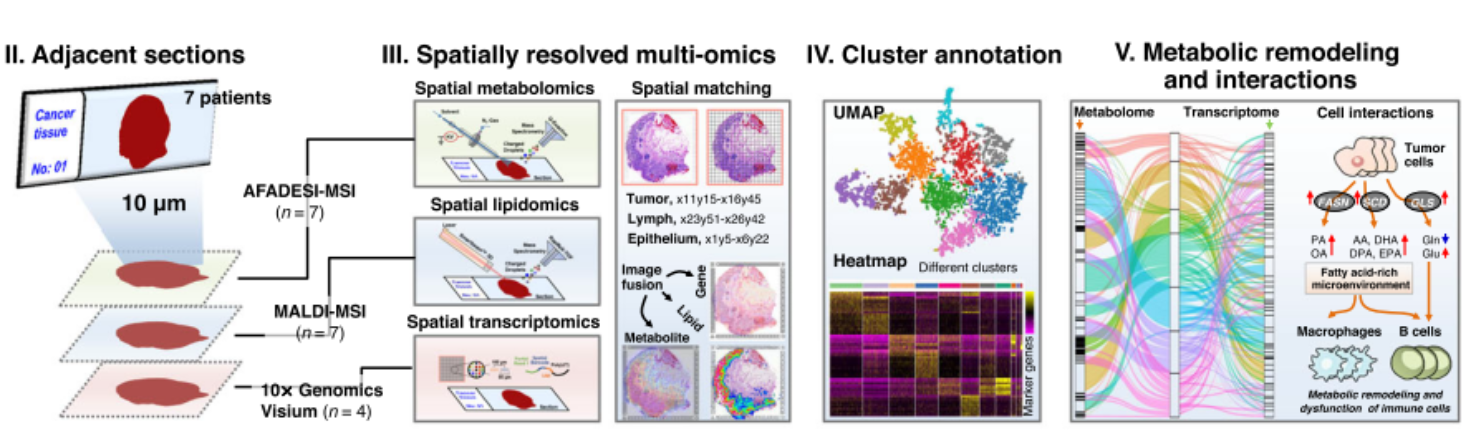
近年來,組學技術的發展極大地推動了人們對腫瘤的認識和臨床精準診治。然而,基于組織勻漿或單細胞解離的組學分析技術會破壞組織中細胞和分子所處的空間位置,無法獲得高異質性腫瘤組織(微環境)中的分子和細胞的分布及相互作用信息。在前期自主研發的空間代謝組學技術的基礎上,進一步整合空間脂質組學和空間轉錄組測序技術,在同一腫瘤組織樣本的相鄰切片上,實現了腫瘤組織微區中代謝組、脂質組和轉錄組數據的原位精準聯合分析;并鑒別細胞種類,構建代謝物/脂質和上游調控基因的關聯網絡,實現了腫瘤組織微環境中腫瘤細胞、免疫細胞和基質細胞等代謝調控及交互作用的原位表征,為腫瘤代謝的深入研究提供了創新的有效方法、工具和新視角。
進一步對臨床術后胃腺癌組織進行了空間多組學分析,發現胃癌腫瘤細胞中精氨酸和脯氨酸代謝、磷脂合成及代謝、脂肪酸生物合成等通路在代謝和轉錄水平上均發生了顯著的異常改變;發現腫瘤細胞的氧化磷酸化代謝水平發生逐漸上調,下游代謝物如磷酸化葡萄糖、蘋果酸、琥珀酸、組胺、硫苷酯等分子隨著胃癌的進展發生持續變化;尤其發現了一個富含免疫細胞的狹長“腫瘤邊界區域”,該區域中免疫細胞發生了代謝重編程,相比正常組織中的免疫細胞,其谷氨酰胺代謝、多不飽和脂肪酸表達都顯著上調,提示腫瘤免疫屏障(逃逸)可能與谷氨酰胺代謝和多不飽和脂肪酸代謝密切相關。這些各類細胞特異的代謝重編程在胃癌的發生發展和免疫逃逸等過程中發揮重要作用,有望成為腫瘤精準治療的潛在靶點。
齊魯工業大學(山東省科學院)孫成龍研究員、北京大學腫瘤醫院王安強副教授、藥物所碩士生周晏合為本文共同第一作者。藥物所賀玖明研究員、北京大學腫瘤醫院季加孚教授、步召德教授和上海市生物醫藥技術研究院戴文韜副研究員為本文的共同通訊作者。本研究受到國家自然科學基金、中國醫學科學院醫學與健康科技創新工程(2022-I2M-2-001)、山東省泰山學者計劃等項目的資助。
論文鏈接:https://www.nature.com/articles/s41467-023-38360-5