
2020年9月18日,中國醫學科學院放射醫學研究所在Nucleic Acids Research上發表題為 “NRF2 preserves genomic integrity by facilitating ATR activation and G2 cell cycle arrest”的最新研究進展。該研究首次發現電離輻射損傷后,NRF2蛋白被招募到DNA損傷位點,并與ATR相互作用,從而激活ATR-CHK1-CDC2信號通路,促進DNA通過同源重組修復方式進行修復,從而保持基因組的穩定性。該研究結果首次揭示了NRF2作為ATR激活因子促進DNA損傷修復的新功能。
電離輻射誘導DNA損傷并導致細胞死亡是輻射造成機體損傷的重要基礎。探索電離輻射誘導DNA損傷及其修復的深入機制,并尋找促進DNA損傷修復的新靶點是近年來放射醫學研究的前沿熱點問題。NRF2(Nuclear factor erythroid 2-related factor 2)是一種核轉錄因子,可以調控細胞內多種抗氧化基因表達。由于NRF2具有較強的抗氧化調控能力,所以NRF2表達升高被普遍認為是細胞發生輻射抵抗的重要原因。然而,NRF2在DNA損傷修復過程中的具體角色及其作用仍不明確。
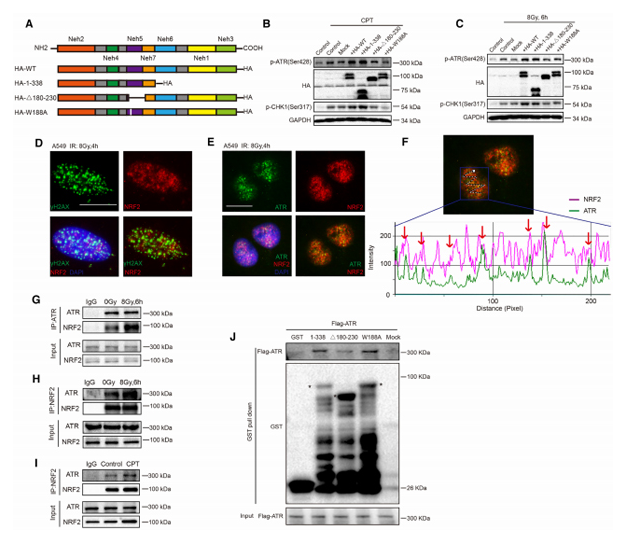
該團隊發現NRF2可以通過非依賴調控ROS(Reactive oxygen species)的途徑直接參與DNA損傷修復過程。降低NRF2表達水平會導致細胞基因組不穩定性升高,DNA損傷修復能力減弱,同源重組修復(HR,Homologous recombination repair)效率降低,DNA損傷修復過程中的G2期細胞周期阻滯減弱。
作者進一步探究其作用機制時發現,NRF2可以與DNA損傷應答中的重要激酶ATR在DNA損傷位點結合并調控其磷酸化過程,并且ATR下游CHK1、CDC2、CyclinA等蛋白的活化同樣受到NRF2的調控。另外,氨基酸序列分析顯示NRF2具有“AAD”(ATR activation domain)結構域,通過進一步的實驗研究發現,NRF2可通過AAD結構域與ATR直接結合并發揮對ATR-CHK1-CDC2信號通路的調控作用。同時,作者通過體內移植瘤實驗發現,NRF2抑制劑Brusatol可以明顯抑制DNA輻射損傷的修復,起到輻射增敏作用。
該項工作發現了NRF2在電離輻射誘導DNA損傷修復中的新機制,同時為研究肺癌細胞放療抵抗機制提供了新思路,也為放療增敏藥物的研發提供了新靶點。
該研究得到中國醫學科學院醫學與健康科技創新工程(2017-I2M-1-016, 2019-I2M-2-006)和國家自然科學基金(31670859和81772243)等資助。中國醫學科學院放射醫學研究所劉強研究員、徐暢副研究員和杜利清研究員為論文的共同通訊作者,中國醫學科學院放射醫學研究所孫曉輝博士為論文的第一作者。
論文鏈接:https://academic.oup.com/nar/article-pdf/48/16/9109/33746584/gkaa631.pdf
文字|放射所